Este artigo explora como o Imbruvica® (ibrutinib) funciona, preço, custo do tratamento, como conseguir tratamento no SUS, suas aplicações e o impacto que pode ter na vida dos pacientes. Imbruvica® (ibrutinib) é um medicamento revolucionário no tratamento de cânceres de sangue, como a leucemia linfocítica crônica (LLC) e outras doenças malignas de células B.
Os pacientes com hemoglobinúria paroxística noturna (HPN) ou síndrome hemolítico-urêmica atípica (SHUa), duas doenças potencialmente fatais, receberam uma ótima notícia com a aprovação do Ultomiris para o tratamento das doenças.
Comercializado pela AstraZeneca, o Ultomiris recebeu a aprovação da Food And Drugs Administration, órgão regulador de medicamentos nos Estados Unidos, para o tratamento de adultos com miastenia gravis generalizada (gMG), uma doença neuromuscular rara, debilitante, crônica e autoimune que leva à perda da função muscular e fraqueza severa. O fato foi comemorado por Marc Dunoyer, CEO da Alexion, AstraZeneca Rare Disease, grupo da AstraZeneca focado em doenças raras.
Produzido sob a substância ativa atezolizumab, o Tecentriq recebeu a aprovação da European Medicines Agency, órgão regulador de medicamentos na União Europeia, para o tratamento de quatro tipos diferentes de câncer. Após uma série de testes, a agência europeia reconheceu a eficácia do medicamento para o tratatamento de pacientes com câncer urotelial (câncer da bexiga e do sistema urinário), câncer de pulmão, um tipo de câncer de mama conhecido como câncer de mama triplo negativo e carcinoma hepatocelular, um câncer que começa no fígado.
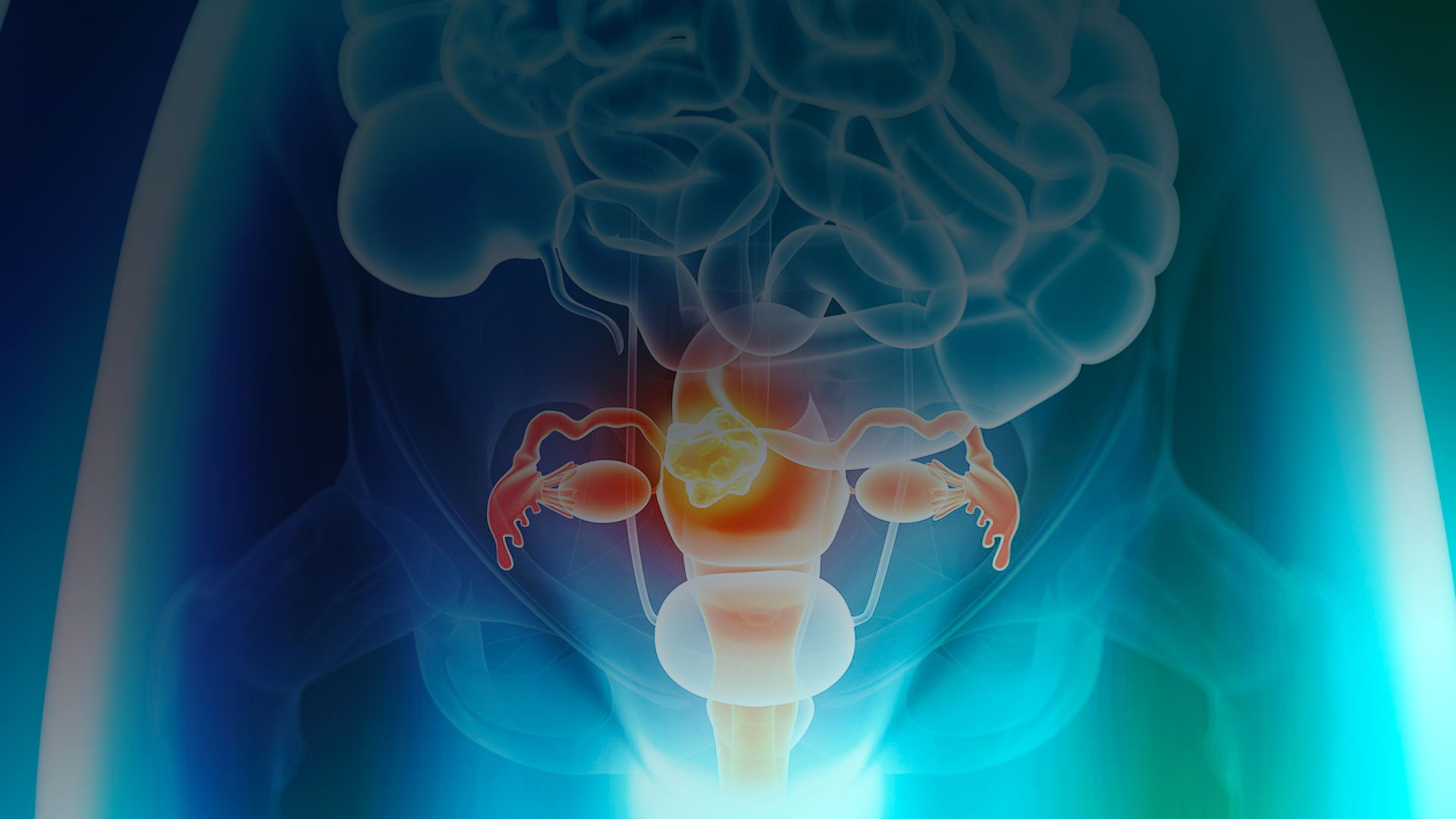
A Divisão de Informações sobre Medicamentos da Food And Drugs Administration, em parceria com o Centro de Excelência em Oncologia da agência que regula medicamentos nos Estados Unidos, anunciou a aprovação do tisotumab vedotin-tftv (nome comercial do Tivdak) para o tratamento de pacientes adultos com câncer cervical recorrente ou metastático - com progressão da doença durante ou após a quimioterapia.
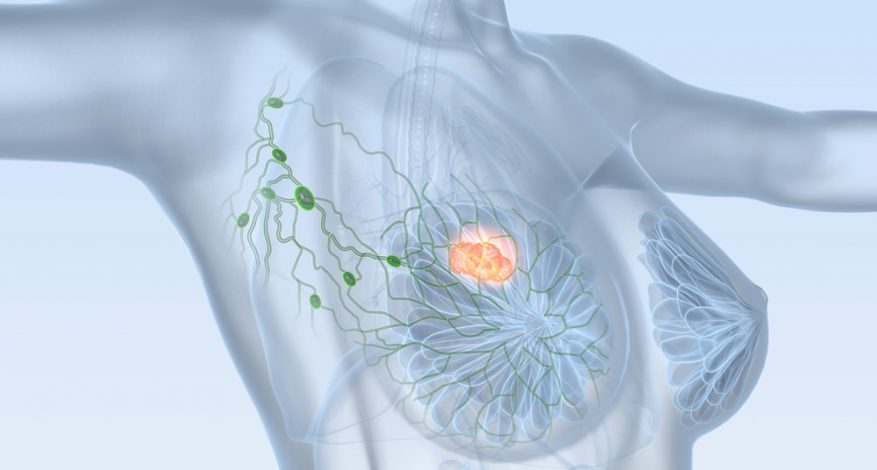
Destinado ao tratamento o tratamento de câncer de mama metastático HER2-positivo em pacientes adultas que foram previamente tratadas para sua doença metastática, o Margenza recebeu a aprovação da Food And Drugs Administration, órgão regulador de medicamentos dos Estados Unidos, após rigorosos testes. Comercializado em forma de injeção, o Margenza deve ser administrado por um profissional de saúde diretamente na veia, ou seja, por infusão intravenosa, a cada três semanas e em combinação com a quimioterapia.
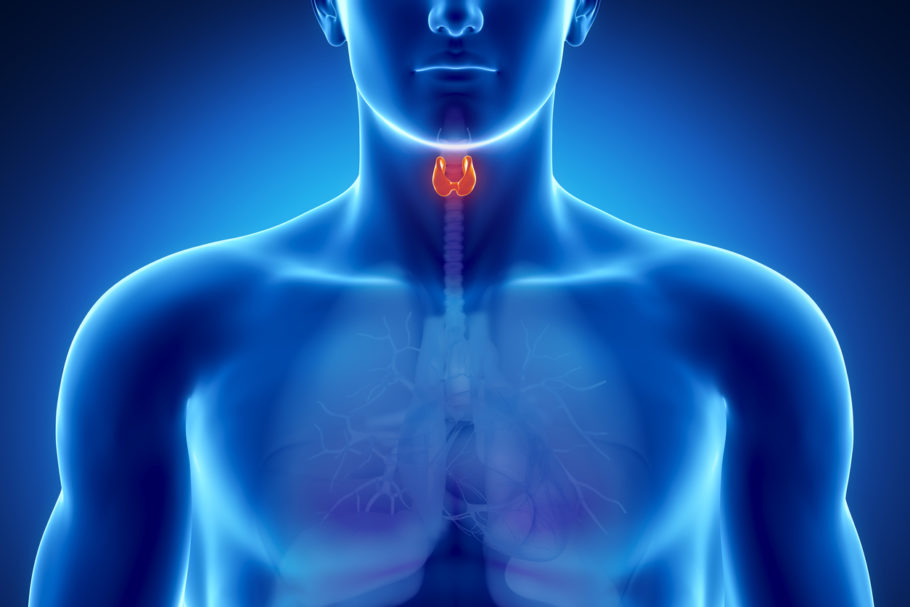
A Food and Drug Administration (FDA), órgão regulador de medicamentos dos Estados Unidos, aprovou o Tepezza para o tratamento de adultos com doença ocular da tireoide. A condição rara, que faz com que os músculos e tecidos adiposos atrás do olho fiquem inflamados, provoca a proptose, ou seja, quando os olhos são empurrados para a frente. Produzido sob a substância ativa teprotumumab-trbw, o medicamento é o primeiro a receber a aprovação para o tratamento da doença ocular da tireoide.