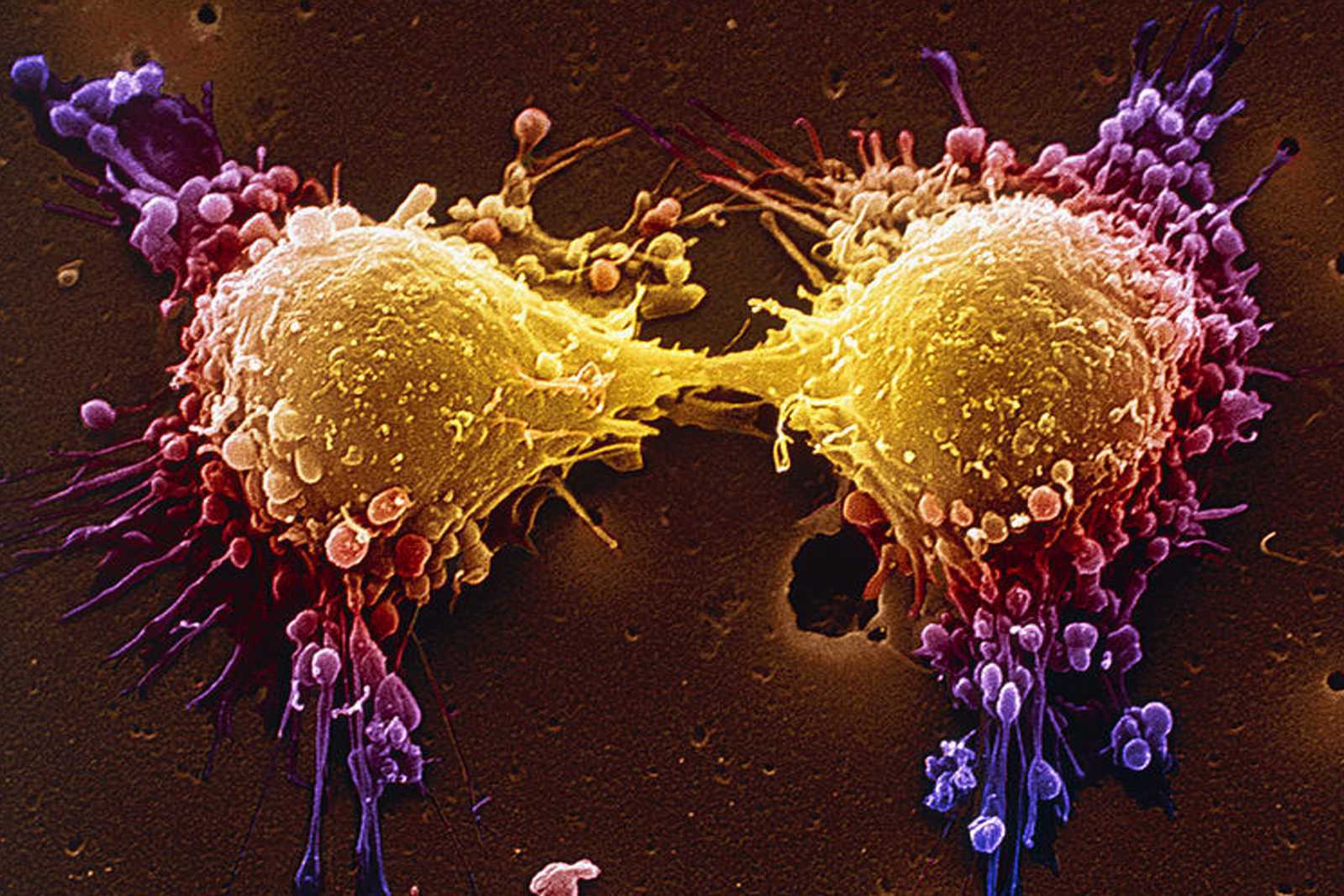
A Food and Drug Administration (FDA) agência reguladora de medicamentos nos Estados Unidos, concedeu, pela primeira vez, aprovação a um medicamento contra carcinoma cutâneo escamoso avançado (sob as seguintes especificidades: metastático, localmente avançado e que não são candidatos a cirurgia ou radioterapia). Trata-se da injeção de Libtayo (cemiplimab), de uso intravenoso, que atua direcionando a proteína PD-1 e combatendo as células cancerígenas.
A Agência Europeia de Medicamentos (EMA) - agência responsável pela avaliação científica, supervisão e monitorização da segurança dos medicamentos na União Europeia - aprovou o Translarna para tratamento de pacientes com Distrofia Muscular de Duchenne (DMD), doença de herança recessiva ligada ao cromossomo X. Hereditária, a DMD tem registros de manifestações clínicas desde a infância, provocando enfraquecimento muscular progressivo, o que requer rápido tratamento com a manipulação de medicamentos como o Translarna.
Após uma série de testes, a European Medicine Agency (EMA), órgão criado em 1995 como regulador de medicamentos na Europa, concedeu aprovação ao Myalept (Metreleptina) para o tratamento de Lipodistrofia. O medicamento, comercializado pela Aegerion Pharmaceuticals, se mostrou capaz de agir contra as complicações provocadas pela doença, caracterizada pela deficiência de leptina, responsável pelo mau armazenamento de gordura no corpo. O Myalept é prescrito junto a uma dieta recomendada para, além de repor leptina, amenizar os danos da Lipodistrofia generalizada.
Desde 1996, a lei das patentes instituiu novas práticas no mercado brasileiro de medicamentos. Superados 20 anos da fabricação do produto, o remédio teria sua composição química divulgada e outros laboratórios poderiam formular versões genéricas, que prometiam eficiência similar a um custo muito mais baixo. O sucesso da medida teve, entretanto, um efeito colateral: a ideia de que medicamentos importados eram necessariamente mais caros do que suas versões nacionais. Nada mais longe da verdade. Se a tese é coerente com a realidade em alguns casos, em muitos outros importar o medicamento se mostra mais seguro e vantajoso também do ponto de vista financeiro.
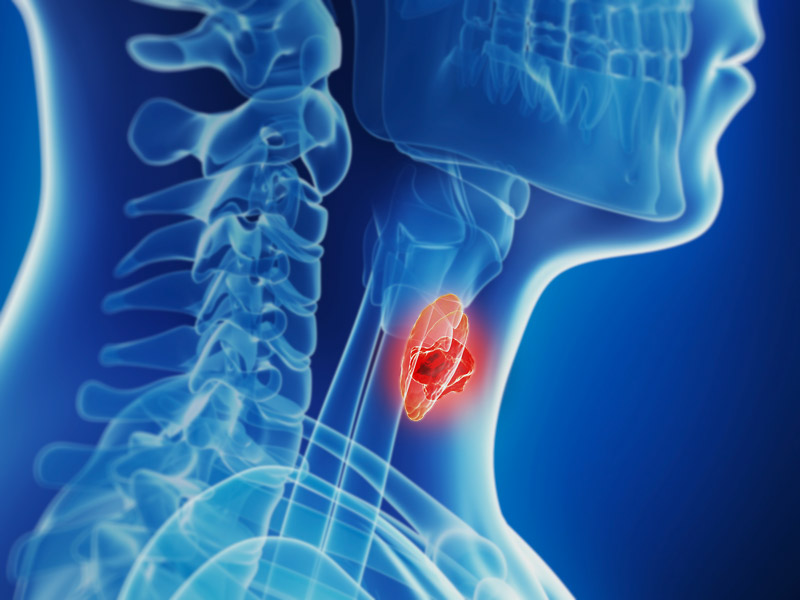
Comercializado pela AstraZeneca em cápsulas de 100 / 300 mg, o Caprelsa ostenta o reconhecimento em ser o primeiro medicamento aprovado pelo FDA para o tratamento de pacientes com carcinoma medular de tireoide (MTC) localmente avançado irressecável ou metastático. A indicação do órgão regulador estadunidense considera a utilização em casos de impossibilidade da remoção por cirurgia ou quando o tumor se espalha para outras partes do corpo. A aprovação do Caprelsa se deu por sua inibição à quinase, um tipo de enzima que pode sinalizar a ativação de outras moléculas em uma célula, incluindo uma célula cancerosa.
A European Medicines Agency (EMA), órgão regulador do monitoramento científico, da avaliação, supervisão e segurança dos medicamento desenvolvidos por laboratórios farmacêuticos no Velho Continente, concedeu aprovação ao Translarna, desenvolvido pela PTC Therapeutics, a para tratamento da Distrofia Muscular de Duchenne (DMD). Designado como medicamento órfão pela EMA, ou seja, destinado a doenças raras, o Translarna apresentou eficácia em sua atuação contra a doença hereditária, responsável por provocar fraqueza muscular e gradativa perda da função.
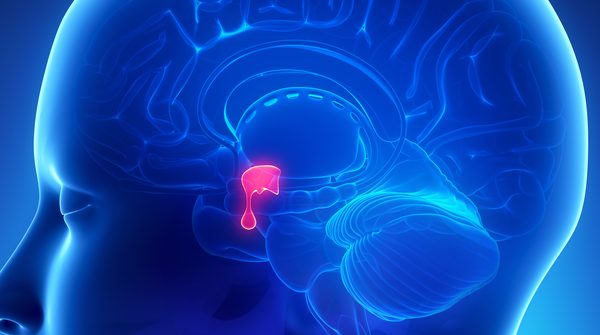
Produzido pela Ipsen Biopharmaceuticals, Inc, o Somatuline recebeu aprovação da Food and Drug Administration (FDA), agência federal do Departamento de Saúde e Serviços Humanos dos Estados Unidos, para o tratamento de acromegalia, distúrbio em adultos em que a glândula pituitária produz hormônio de crescimento em excesso. Comercializado em solução injetável (60 mg, 90 mg e 120 mg) o medicamento tem o Acetato de Lanreotida como princípio ativo.
Considerado um raro e grave distúrbio genético, a mucopolissacaridose tipo II (MPS II), popularmente conhecida como Síndrome de Hunter afeta principalmente homens e faz parte das várias doenças de depósito lisossômico, ou seja, das que interferem na capacidade do organismo em quebrar e reciclar determinadas substâncias, no caso, as conhecidas como glicosaminoglicanos (GAGs). Para seu combate, a Global Green Cross criou o Hunterase, uma terapia de reposição enzimática em forma de injeção.
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou uma boa notícia para o tratamento de quem sofre com a Síndrome de Sly, doença rara também conhecida como mucopolissacaridose do tipo VII (MPS VII). Em registro publicado do Diário Oficial da União, o órgão regulador aprovou o Mepsevii, medicamento com alfa vestronidase, princípio ativo indicado para terapia de reposição enzimática. Na Europa, o Mepsevii foi designado como medicamento órfão, ou seja, status dado a medicamentos que tratam doenças raras por um órgão regulatório de saúde oficial do país. No caso do Brasil, a Anvisa considera a indicação para incidência de doenças menor que 5 em cada 10 000 pessoas.
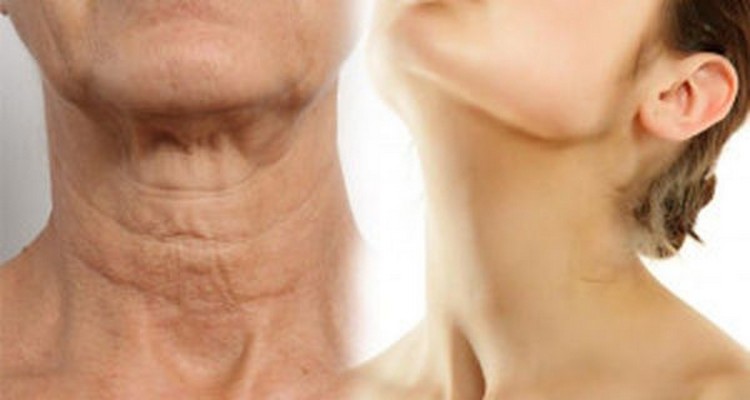
O passar do tempo estampado no rosto. Assim, podemos descrever as marcas provocadas pelas rugas que, por mais que representem a história e a trajetória, também podem significar um verdadeiro incômodo para quem as exibe. Nesse caso, a solução é recorrer a medicamentos capazes de amenizar os sinais, como Striadril, uma fórmula tópica bioativa. De rápida absorção pela pele, o creme é uma verdadeira mescla de agentes que aumentam a firmeza, hidratam e melhoram a elasticidade da pele. O Striadril age diretamente nas marcas das rugas, diminuindo o seu comprimento, melhoram a textura da região e pode descolorir a linha.